近日美国食品药品监督管理局(FDA)已基于补充新药申请(sNDA),批准了司美格鲁肽/索马鲁肽的新增适应症。从现在起,在控制饮食和增加体力活动的基础上,司美格鲁肽可用于治疗代谢相关脂肪性肝炎(MASH)伴中重度肝纤维化(符合 F2-F3 期纤维化)的非肝硬化成人患者。这一批准犹如一颗重磅炸弹,在医药界尤其是肝病治疗领域掀起波澜。
司美格鲁肽/索马鲁肽此次获批具有里程碑意义,它成为首个也是目前唯一一个被批准用于治疗代谢相关脂肪性肝炎(MASH)的 GLP-1 类药物。这一成果进一步丰富了司美格鲁肽在减重、心血管获益等大量临床数据之外的获益证据,让这款原本聚焦于代谢领域的药物,在肝病治疗领域开辟了新赛道。
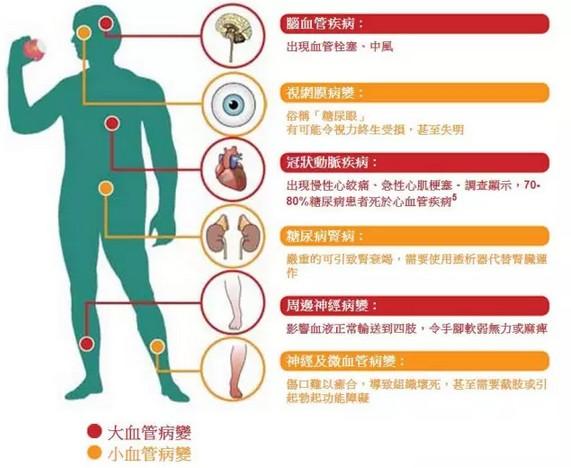
代谢相关脂肪性肝炎(MASH)是一种严重危害人类健康的疾病。据了解,全球范围内 MASH 患者数量已超过 2.5 亿人,形势极为严峻;且预计到 2030 年,处于该病晚期的患者数量将翻倍,而全球三分之一的超重或肥胖人群都患有 MASH。仅在美国,就有约 2200 万 MASH 患者。在过去,MASH 的治疗手段极为有限,患者长期面临 “无药可治” 的困境,只能通过调整生活方式延缓病情,而司美格鲁肽的出现,无疑为这些患者带来了全新的治疗方案 —— 它不仅能阻止疾病活动,更令人惊喜的是,还有望帮助逆转肝脏损伤。自获批之日起,司美格鲁肽在美国已正式可用于治疗 MASH,为众多患者开启了新的希望之门。
此次司美格鲁肽/索马鲁肽获批新适应症,核心依据是 ESSENCE 临床试验第一阶段的成果。该试验数据极具说服力,从统计学角度清晰展现了司美格鲁肽相较于安慰剂在治疗 MASH 方面的显著优势。
试验结果显示,在治疗第 72 周时:
接受司美格鲁肽/索马鲁肽治疗的受试者中,有 36.8% 实现了 “肝纤维化改善且脂肪性肝炎无恶化”,而安慰剂组中这一比例仅为 22.4%,差距显著;
同时,62.9% 接受司美格鲁肽/索马鲁肽治疗的受试者达到 “脂肪性肝炎改善且肝纤维化无恶化” 的标准,安慰剂组的这一比例则为 34.3%,司美格鲁肽的治疗优势进一步凸显。
这些数据并非偶然,而是通过严格的临床试验设计得出,直观证明了司美格鲁肽/索马鲁肽能切实改善 MASH 患者的肝脏病理状态,为患者的健康带来实质性改变。