Talazoparib tosylate是一种聚腺苷二磷酸核糖聚合酶1/2(PARP-1和PARP-2)抑制剂,最初由LEAD Therapeutics(2010年被BioMarin收购)研发。2015年8月,Medivation与BioMarin签订资产购买协议,Medivation获得该药的所有研发及商业化权利。后该药物被辉瑞收购。该药于2018年10月16日获美国FDA批准上市,商品名为Talzenna®,被批准用于治疗BRCA突变/HER-2阴性转移性乳腺癌,成为FDA批准的第四个PARP抑制剂。
Talazoparib的获批是基于一项开放标签的临床三期试验(NCT01945775),主要研究终点为PFS。Talazoparib组与标准单药化疗组(卡培他滨、艾日布林、吉西他滨或长春瑞滨)的中位PFS分别为8.6个月和5.6个月(HR=0.542,p<0.0001),具有显著性差异。
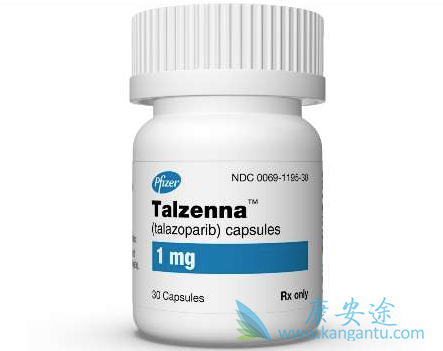
talazoparib是一种聚ADP-核糖聚合酶(PARP)抑制剂。临床前研究表明,talazoparib高度有效,具有双重作用机制,可以通过阻断PARP酶活性以及将PARP捕获在DNA损伤位点上来诱导肿瘤细胞死亡。目前,talazoparib正被评估用于gBRCAm乳腺癌及早期TNBC以及DNA损伤修复(DDR)缺陷的其他类型癌症。
此次批准,使Talzenna成为美国FDA批准的第4款PARP抑制剂,该药上市后将与阿斯利康的Lynparza、Clovis公司的Rubraca、Tesaro公司的Zejula展开竞争。需要指出的是,接受Talzenna治疗的患者必须经FDA批准的一款伴随诊断试剂盒检测证实适合该药治疗。
更多新闻请您访问 肿瘤 https://www.kangantu.com/









请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)