10月31日,FDA批准诺华旗下Sandoz生产的阿达木单抗类似物Hyrimoz(adalimumab-adaz)上市,用于治疗类风湿关节炎、幼年特发性关节炎、银屑病关节炎、强制性脊柱炎、成人克罗恩病、溃疡性肠炎、斑块状银屑病等8种适应症。
Hyrimoz是FDA继安进Amjevita(2016/9/23)、勃林格殷格翰Cyltezo(2017/8/25)之后批准的第3个阿达木单抗类似物。此外,Samsung Bioepis/Biogen的阿达木单抗类似物的上市申请也正处于FDA审批阶段。
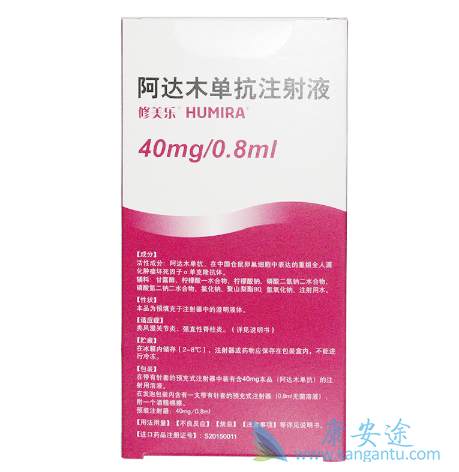
由于专利保护问题,目前市场上还没有Humira的类似物开始销售。2017年9月29日,Amgen与AbbVie达成专利诉讼和解,获得AbbVie的非独家专利许可授权,在欧盟大多数国家可以自2018年10月16日起销售Amjevita,不过该授权在美国市场自2023年1月31日起生效。2018年4月6日,Samsung Bioepis与AbbVie达成和解,在欧盟大多数国家可以自2018年10月16日起销售Cyltezo,但该授权在美国市场自2023年6月30日起生效。勃林格殷格翰、Sandoz与AbbVie的专列纠纷尚未有明确定论。
修美乐是全球第一个上市的抗TNF-α药物,自2002年首次获得FDA批准上市以来,已经累计创造了近1000亿美元的销售收入,而且直到今天还以每年两位数的增幅刷新单只药品的年度销售记录。Humira在2017年的全球销售额是184.27亿美元,今年上半年的全球销售额是98.94亿美元。
更多新闻请您访问 肿瘤 https://www.kangantu.com/









请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)