印度厄洛替最常规的EGFR TKI用于一线EGFR m +转移性NSCLC 1 *
-
超过23,000名一线EGFR m +患者治疗1 *
-
美国FDA批准的EGFR TKI第一线治疗转移性NSCLC 2

*自2013年6月以来,针对新的1L Tarceva处方和NSCLC跟踪研究的IMS&SHA数据估计。
在肿瘤学NCCN临床实践指南(NCCN指南®)建议埃罗替尼(特罗凯)如在第一线治疗的选项为患者用致敏EGFR突变阳性转移性NSCLC(第1类)2
转移性NSCLC
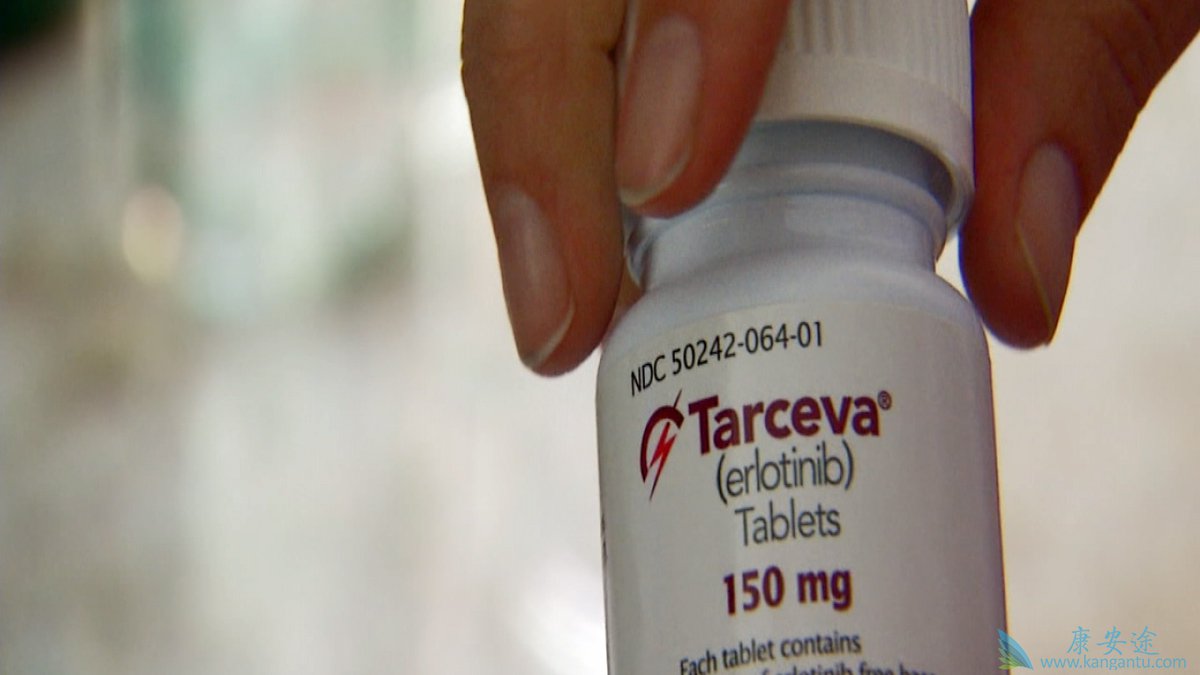
印度厄洛替Tarceva适用于:
-
治疗转移性非小细胞肺癌(NSCLC)患者,其肿瘤具有表皮生长因子受体(EGFR)外显子19缺失或外显子21(L858R)置换突变,通过FDA批准的接受一线维护的检测,或在至少一个以前的化疗方案进行后的第二次或更多次的线治疗。
使用限制:
在非小细胞肺癌患者其肿瘤具有其他EGFR突变的患者中,没有确定Tarceva的安全性和有效性。
印度厄洛替Tarceva不推荐与铂类化疗联合使用。
重要安全信息
警告和注意事项
-
间质性肺疾病(ILD):
-
严重的ILD病例,包括致命的病例,可以用Tarceva治疗。大约32,000名Tarceva治疗的患者在不受控制的研究中并发化疗的ILD的总体发病率约为1.1%。在患有ILD的患者中,症状发作在启动Tarceva治疗后5天至超过9个月(中位数39天)。
-
停用Tarceva急性发作新的或进行性不明原因的肺部症状,如呼吸困难,咳嗽和发烧等待诊断评估。如果ILD被确认,永久停止Tarceva。
-
肾衰竭
-
肝癌综合征,严重急性肾功能衰竭,包括致命性病例和肾功能不全可发生在Tarceva治疗。肾功能衰竭可能由于基础肝损伤或严重脱水加重引起。
-
3个单一疗法肺癌研究中重度肾损害的合并发生率在Tarceva手臂中为0.5%,在对照组为0.8%。在Tarceva加吉西他滨组,胰腺癌研究中肾损伤的发生率为1.4%,对照组为0.4%。
-
在发生严重肾功能衰竭的患者中停用Tarceva,直到肾毒性解决。在Tarceva治疗期间执行肾功能和血浆电解质的定期监测。
-
肝脏有无肝功能损害:
-
肝毒性:一名印度厄洛替Tarceva治疗的患者经历致命的肝衰竭,另外四名患者经历3-4级肝脏检查异常。
-
肝功能衰竭和肝肾综合征,包括致命性病例,可在Tarceva治疗中发生肝功能正常的患者; 基线肝功能损害患者的肝毒性风险增加。
-
在排除中度至重度肝损伤患者的临床研究中,3项单一疗法肺癌研究中肝功能衰竭的合并发生率在Tarceva组为0.4%,对照组为0%。在Tarceva加吉西他滨组,胰腺癌研究中肝功能衰竭发生率为0.4%,对照组为0.4%。
-
在用Tarceva治疗期间进行定期肝脏检查(转氨酶,胆红素和碱性磷酸酶)。预先存在肝损伤或胆道梗阻的患者需要增加监测肝功能的频率。
-
在总胆红素> 3×ULN或转氨酶> 5×ULN的患者中未预先存在肝损伤的Tarceva。在预先存在肝损伤或胆道梗阻的患者中停用Tarceva以使胆红素翻倍或转氨酶值超过基线值的三倍。
-
在符合上述标准的异常肝脏检查的患者中停止Tarceva不会显着改善或在3周内解决。
-
胃肠穿孔:
-
胃肠道穿孔,包括致命的病例,可以在印度厄洛替Tarceva治疗中发生。接受伴随的抗血管生成剂,皮质类固醇,NSAID或基于紫杉烷的化学疗法或具有消化性溃疡或憩室疾病的先前病史的患者可能具有增加穿孔的风险。
-
3种单药治疗肺癌研究中胃肠道穿孔的合并发生率在Tarceva组为0.2%,对照组为0.1%。胰腺癌研究中胃肠穿孔的发生率在Tarceva加吉西他滨组为0.4%,对照组为0%。
-
在发展胃肠穿孔的患者中永久停止Tarceva。
-
大疱和剥脱性皮肤疾病:
-
大疱,起泡和剥脱性皮肤病症,包括史蒂文生 - 约翰逊综合征/毒性表皮坏死松解症的病例,在某些情况下是致命的,可以在Tarceva治疗中发生。
-
3种单一疗法肺癌研究中大疱和剥脱性皮肤病发病率的集中发生率在Tarceva组为1.2%,对照组为0%。在Tarceva加吉西他滨组,胰腺癌研究中大疱和剥脱性皮肤病发生率为0.4%,对照组为0%。
-
如果患者出现严重的大泡,起泡或去角质状况,则停止治疗Tarceva。
-
脑血管事故:
-
在胰腺癌试验中,Tarceva加吉西他滨组7例患者发生脑血管意外(发生率:2.5%)。其中一个是出血性的,是唯一的致命事件。相比之下,安慰剂加吉西他滨组没有发生脑血管意外。在3组单肺治疗肺癌研究中,脑血管意外共发生率在Tarceva组为0.6%,不高于对照组。
-
血小板减少症微血管病溶血性贫血:
-
3个单一治疗肺癌研究中血小板减少症的微血管病变溶血性贫血的合并发生率在Tarceva组为0%,对照组为0.1%。胰腺癌研究中血小板减少症的微血管病溶血性贫血发生率在Tarceva加吉西他滨组为1.4%,对照组为0%。
-
眼部疾病:
-
Tarceva治疗可能导致泪液生成减少,睫毛生长异常,角膜结膜炎或角膜炎角膜炎,可导致角膜穿孔或溃疡。
-
3种单一治疗肺癌研究中眼部疾病的合并发生率在Tarceva手臂中为17.8%,在对照组为4%。在Tarceva加吉西他滨组,胰腺癌研究中眼部疾病的发生率为12.8%,对照组为11.4%。
-
如果患者出现急性或恶化的眼部疾病如眼睛疼痛,则中断或停止Tarceva治疗。
-
出血患者服用华法林:
-
当Tarceva和华法林同时施用时,可能发生与国际标准化比例(INR)升高相关的严重和致命性出血。
-
在使用华法林或其他香豆素衍生物抗凝剂的患者中,在Tarceva治疗期间定期监测凝血酶原时间和INR。
-
胚胎 - 胎儿毒性:
-
根据动物数据及其作用机制,Tarceva可以在对孕妇施用时引起胎儿的伤害。向怀孕妇女提供对胎儿的潜在风险。
-
建议女性的生殖潜力在治疗期间使用有效的避孕措施,以及最后一次剂量的Tarceva后一个月。
-
最常见的不良反应
-
转移性NSCLC - EGFR突变患者的一线治疗:
-
最常见的(≥30%)不良反应为腹泻,乏力,皮疹,咳嗽,呼吸困难,食欲下降。
-
最常见的3/4级(NCI-CTC 3.0版)不良反应为皮疹(14%)和腹泻(5%)。在Tarceva治疗的患者中,最常报告的导致剂量改变的不良反应为皮疹(13%),腹泻(10%)和乏力(3.6%)










请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)